1.- Escribe y comenta las clases de materia.
Materia Orgánica.- Materia orgánica es estudiada por la química orgánica. Las moléculas orgánicas que constituyen la materia son derivadas del carbono.
Ej.- Glucosa tiene 6 carbonos Metal tiene unoEl carbono puede combinarse consigo mismo infinidad de veces, y dar lugar a moléculas muy grandes y complejas.
Materia Inorgánica.- Materia inorgánica es estudiada por la química inorgánica. Está formada por moléculas más simples. La materia inorganica no es derivada del carbono.
Materia viva.- La materia viva es la materia que forma parte de los seres vivos. Puede ser orgánica (proteínas, lípidos, azúcares, etc.) y también puede ser inorgánica (agua, sales minerales).
3.-Además de protón, electrón y neutrón, nombra otras particulas subatómicas.
-Bosón-Fermión-Hadrón-Leptón-Mesón-Positrón-Neutrino-Quark
4.-redacta 5 medidas viables para mejorar el consumo de alimentos en los ambientes donde se expenden alimentos.
-No debemos dejar restos de alimentos en el suelo o sobre una mesa, porque estos alimentos tienden a podrirse cuando estan expuestos al ambiente, causando contaminación.
- Al terminar de consumir el alimento no debemos votar la cascara o envoltura al suelo, sino arrojarlo al tacho de basura más cercano.
-Podemos recoger y reciclar, botellas y papeles dejados por los consumidores.
-Poner carteles y avisos para qu los consumidores no arrogen desperdicios y tomen conciencia del daño que están cometiendo.
CORRECCION PRUEBA ESCRITA CTA
lunes, 26 de marzo de 2007 |
Publicado por
Julio Luis Coronel Oblitas
en
21:24
0
comentarios
![]()
NUEVO CUESTIONARIO DE CTA
1.1.- ¿Qué es la materia?
Todo lo que podemos ver y tocar es materia. También son materia cosas que no podemos ver, como el aire. Observamos que la materia ocupa una cierta porción de espacio que llamamos volumen. En el caso del aire esto no es evidente, pero la siguiente experiencia nos ayudará a comprobarlo.
En física, la materia es aquello de lo que están hechos los objetos que forman el Universo que observamos. Si bien durante un tiempo se consideraba que la materia tenía dos propiedades que juntas la caracterizan: que ocupa un lugar en el espacio y que tiene masa, en el contexto de la física moderna se entiende por materia cualquier campo, entidad o discontinuidad que se propaga a través del espacio-tiempo a una velocidad inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
También se puede dar un concepto filosófico de lo que es materia y nos dice que desde el comienzo de la filosofía, y en casi todas las culturas, se encuentra este concepto vagamente formulado como lo que permanece por debajo de las apariencias cambiantes de las cosas de la naturaleza.
Según esto todo está dado en sus diversas y cambiantes apariencias en un soporte o entidad en la que radica el movimiento y cambio de las cosas: la materia.
“La materia es la masa de la que todo sale y a la que todo vuelve, ligada desde el comienzo con lo sensible, y en oposición a lo que no se ve por los sentidos, la vida, el espíritu, la inteligencia”.

1.2.- ¿Qué clases de materia existen? (Criterios de clasificación)
La materia se clasifica en:
Materia Orgánica.- Materia orgánica es estudiada por la química orgánica. Las moléculas orgánicas que constituyen la materia son derivadas del carbono.
Ej.- Glucosa tiene 6 carbonos Metal tiene unoEl carbono puede combinarse consigo mismo infinidad de veces, y dar lugar a moléculas muy grandes y complejas.
Materia Inorgánica.- Materia inorgánica es estudiada por la química inorgánica. Está formada por moléculas más simples. La materia inorganica no es derivada del carbono.
Materia viva.- La materia viva es la materia que forma parte de los seres vivos. Puede ser orgánica (proteínas, lípidos, azúcares, etc.) y también puede ser inorgánica (agua, sales minerales).
2.- ÁTOMO
2.1.- ¿Qué es átomo?
· Es la unidad más pequeña posible de un elemento químico. En la filosofía de la antigua Grecia, la palabra "átomo" se empleaba para referirse a la parte de materia más pequeño que podía concebirse. Esa "partícula fundamental", por emplear el término moderno para ese concepto, se consideraba indestructible. De hecho, átomo significa en griego "no divisible". El conocimiento del tamaño y la naturaleza del átomo avanzó muy lentamente a lo largo de los siglos ya que la gente se limitaba a especular sobre él.· En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.

2.2.- Descripción de las teorías atómicas y modelos (esquemas) atómicos.
Descripción
El concepto de átomo existe desde la Antigua Grecia propuesto por los filósofos griegos Demócrito, Leucipo y Epicuro, sin embargo, no se generó el concepto por medio de la experimentación sino como una necesidad filosófica que explicara la realidad, ya que, como proponían estos pensadores, la materia no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas creara todos los cuerpos macroscópicos que nos rodean.
El siguiente avance significativo se realizó hasta en 1773 el químico francés Antaine-Laurent de Lavoisier postuló su enunciado: "La materia no se crea ni se destruye, simplemente se transforma."; demostrado más tarde por los experimentos del químico inglés John Dalton quien en 1804, luego de medir la masa de los reactivos y productos de una reacción, y concluyó que las sustancias están compuestas de átomos esféricos idénticos para cada elemento, pero diferentes de un elemento a otro.
Luego en 1811 Amedeo Avogadro, físico italiano, postuló que a una temperatura, presión y volumen dados, un gas contiene siempre el mismo número de partículas, sean átomos o moléculas, independientemente de la naturaleza del gas, haciendo al mismo tiempo la hipótesis de que los gases son moléculas poliatómicas con lo que se comenzó a distinguir entre átomos y moléculas.
El químico ruso Dmítri Ivánovich Mendeléyev creó en 1869 una clasificación de los elementos químicos en orden creciente de su masa atómica, remarcando que existía una periodicidad en las propiedades químicas. Este trabajo fue el precursor de la tabla periódica de los elementos como la conocemos actualmente.
La visión moderna de su estructura interna tuvo que esperar hasta el experimento de Rutherford en 1911 y el modelo atómico de Bohr. Posteriores descubrimientos científicos, como la teoría cuántica, y avances tecnológicos, como el microscopio electrónico, han permitido conocer con mayor detalle las propiedades físicas y químicas de los átomos.

Modelos atómicos
Modelo de Dalton
Fue el primer modelo atómico con bases científicas, fue formulado en 1804 por John Dalton. Este primer modelo atómico postulaba:
La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
Los átomos, al combinarse para formar compuestos guardan relaciones simples.
Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos ni la radioactiviadad.
Modelo de Thomson
Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel.

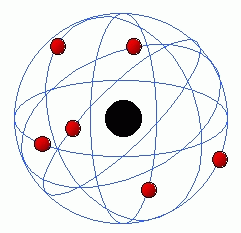
Modelo de Rutherford
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico. Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.
No explicaba los espectros atómicos.
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
De acuerdo a esto, el átomo propuesto por Bohr consiste en un núcleo de hidrógeno alrededor del cual gira en órbitas circulares un electrón, ocupando la órbita permitida de menor energía, es decir, la más cercana al núcleo. El número de órbitas permitidas para el electrón se encuentra restringido por su nivel energético, y el electrón puede pasar a una órbita de mayor energía solamente absorbiendo una cantidad de energía específica (cuanto). El proceso inverso también es posible, que un electrón pase de una órbita de mayor energía a una de menor, liberando una cantidad específica de energía.

Modelo de Schrödinger: Modelo Actual
Densidad de probabilidad de ubicación de un electrón para los primeros niveles de energía.
Luego de que Louis-Victor de Broglie propuso la naturaleza ondulatoria de la materia en 1924, la cual fue generalizada por Erwin Schrödinger en 1926, se actualizó nuevamente el modelo del átomo.
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo, que es una extrapolación de la experiencia a nivel macroscópico hacia las diminutas dimensiones del átomo. En vez de esto, Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital. La gráfica siguiente muestra los orbitales para los primeros niveles de energía disponibles en el átomo de hidrógeno y oxígeno.

3.- ESTRUCTURA
3.1.- Partes del átomo, descripción de las principales
En el átomo dos partes importantes: el núcleo y la corteza.
Núcleo.- El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón.Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z.
Corteza.-La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón.Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones.
3.2.- Otras partículas subatómicas
Aparte del electrón, protón y neutrón existen otras partículas subatómicas, las cuales son:
-Bosón
-Fermión
-Hadrón
-Leptón
-Mesón
-Positrón
-Neutrino
-Quark
4.- DEFINICIÓN Y EJEMPLOS DE:
4.1.- Elemento.- Es el término usado en química para identificar distintos átomos: el hidrógeno es un elemento y el oxigeno es otro, ya que ambos son átomos distintos.
Ejemplos: Carbono (C), Oxigeno (O), Hidrógeno (H), Nitrógeno (N), los cuales son los más importantes.

4.2.- Mezcla.-En una mezcla se unen dos o más sustancias sin perder sus propias características. Hay mezclas naturales y artificiales.
Ejemplo:
Los sólidos son las rocas, como el basalto que es una mezcla de origen volcánico.


4.3.- Compuesto.- Son aquellas sustancias cuyas moléculas están formadas por átomos de distinta clase.
Ejemplo:
El agua. En cada molécula de agua, hay dos átomos de hidrógeno y un átomo de oxígeno. Al descomponer químicamente cualquiera de estas sustancias, se obtienen dos o más sustancias simples.
4.4.- Soluciones.- Se laman soluciones a las mezclas de un sólido, de un líquido o un gas con un líquido.
Clases de soluciones:
Solución diluida: Se produce cuando el disolvente tiene mayores cantidades que en el soluto.
Solución saturada: se produce cuando el soluto tiene mayores cantidades, tanto hasta que no se disuelva más en el disolvente.
Ejemplo: Una taza de café con poca azúcar es un ejemplo de solución diluida; si añadimos azúcar hasta que no se disuelva más, lograremos una solución saturada.
5.-CICLOS BIOGEOQUÍMICOS
5.1.- ¿Que son ciclos biogeoquímicos?
Se denomina ciclo biogeoquímico al movimiento de cantidades masivas de carbono, nitrógeno, oxígeno, hidrógeno, calcio, sodio, sulfuro, fósforo y otros elementos entre los componentes vivientes y no vivientes del ambiente (atmósfera y sistemas acuáticos) mediante una serie de procesos de producción y descomposición.
El término ciclo biogeoquímico se deriva del movimiento cíclico de los elementos que forman los organismos biológicos (bio) y el ambiente geológico (geo) e intervienen en un cambio químico.
Existen tres tipos de ciclos biogeoquímicos interconectados,
Gaseoso
Sedimentario
Hidrológico

5.2.- Definición de cada uno:
·Ciclo Gaseoso.- En este ciclo los nutrientes circulan principalmente entre la atmósfera y los organismos vivos. En la mayoría de estos ciclos los elementos son reciclados rápidamente, con frecuencia en horas o días. Los principales ciclos gaseosos son los del carbono, oxígeno y nitrógeno.
· Ciclo Sedimentario.- En este ciclo, los nutrientes circulan entre la corteza terrestre (suelo, rocas y sedimentos), la hidrosfera y los organismos vivos. Los elementos en este ciclo, generalmente reciclan mucho más lentamente que en el ciclo atmosférico, porque los elementos son retenidos en las rocas sedimentarias durante largo tiempo geológico (hasta de decenas a miles de milenios y no tienen una fase gaseosa. El fósforo y el azufre son dos de los 36 elementos reciclados de esta manera.
·Ciclo Hidrológico.- En este ciclo, el agua circula entre el océano, el aire, la tierra y la biota, este ciclo también distribuye el calor solar sobre la superficie del planeta.
5.3.- Influencia en la producción de alimentos:
Los ciclos biogeoquímicos influyen mucho en la producción de los alimentos para los organismos, todo empieza con el ciclo de los nutrientes, desde la abiota (en la atmósfera, la hidrosfera y la corteza de la tierra) hasta la biota, y viceversa, tiene lugar en los ciclos biogeoquímicos (de bio: vida, geo: en la tierra), ciclos, activados directa o indirectamente por la energía solar, incluyen los del carbono, oxígeno, nitrógeno, fósforo, azufre y del agua (hidrológicos). Así, una sustancia química puede ser parte de un organismo en un momento y parte del ambiente del organismo en otro momento. Por ejemplo, una molécula de agua ingresada a un vegetal, puede ser la misma que pasó por el organismo de un dinosaurio hace miles de milenios.
6.-ORGANIZACIÓN DE LOS ELEMENTOS QUÍMICOS
6.1.- Historia
Todo comenzó a mediados del siglo XIX, varios químicos se dieron cuenta de que las similitudes en las propiedades químicas de diferentes elementos suponían una regularidad que podía ilustrarse ordenando los elementos de forma tabular o periódica. El químico ruso Dimitri Mendeléiev propuso una tabla de elementos llamada tabla periódica, en la que los elementos están ordenados en filas y columnas de forma que los elementos con propiedades químicas similares queden agrupados. Según este orden, a cada elemento se le asigna un número (número atómico) de acuerdo con su posición en la tabla, que va desde el 1 para el hidrógeno hasta el 92 para el uranio, que tiene el átomo más pesado de todos los elementos que existen de forma natural en nuestro planeta. Como en la época de Mendeléiev no se conocían todos los elementos, se dejaron espacios en blanco en la tabla periódica correspondientes a elementos que faltaban. Las posteriores investigaciones, facilitadas por el orden que los elementos conocidos ocupaban en la tabla, llevaron al descubrimiento de los elementos restantes. Los elementos con mayor número atómico tienen masas atómicas mayores, y la masa atómica de cada isótopo se aproxima a un número entero, de acuerdo con la hipótesis de Prout.
6.2.- Descripción de la tabla periódica
La tabla periódica consta de 105 elementos químicos, los cuales están clasificados, agrupados y ordenados en forma vertical y horizontal, según las siguientes características:
Cada elemento esta ordenado de acuerdo con su número atómico (es decir, con el número de protones que posee cada uno).
Los elementos que presentan características químicas similares se hallan formando columnas verticales llamadas grupos. Cada grupo esta integrado por elementos que tienen el mismo número de electrones en el último nivel.
Los elementos que tienen el mismo nivel de energía se hallan en la misma fila horizontal llamada período.
Cada elemento esta representado por su correspondiente símbolo químico, formado por una o dos letras.

6.3.- Elementos químicos que hay en Piura en estado de reserva, exportación y explotación.
En piura podemos encontrar elementos como oro, cianuro, arsénico, ácido sulfúrico y demás venenosos elementos químicos de la actividad minera.
7.- PROPONER Y COMPARTIR MEDIDAS DE PREVENCIÓN PARA CUIDAR EL MEDIO AMBIENTE.
· Reciclar la basura que es arrojada día a día al suelo.
· Reclamar a las prestadoras de servicios (agua) que no deben evacuar los desagües en los ríos.
· Evitar el exceso de ruido en el ambiente ya que lo contaminamos.
· Protestar contra las fabricas y choferes irresponsables (que utilizan autos antiguos) por contaminar el ambiente con el humo o smok que producen polución en el ambiente.
Alimentos
Publicado por
Julio Luis Coronel Oblitas
en
16:47
0
comentarios
![]()

¿Qué es átomo?
·Es la unidad más pequeña posible de un elemento químico. En la filosofía de la antigua Grecia, la palabra "átomo" se empleaba para referirse a la parte de materia más pequeño que podía concebirse. Esa "partícula fundamental", por emplear el término moderno para ese concepto, se consideraba indestructible. De hecho, átomo significa en griego "no divisible". El conocimiento del tamaño y la naturaleza del átomo avanzó muy lentamente a lo largo de los siglos ya que la gente se limitaba a especular sobre él.
·En física y química, átomo (del latín atomus, y éste del griego άτομος, indivisible) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
Comentario
Átomo es la unidad más pequeña de un elemento químico que mantiene sus propiedades y que no se puede dividir através de procesos químicos.
¿Cómo se da la unión de los átomos?
Los átomos tienden a unirse formando moléculas y, para ello, deben realizar uniones químicas en las que intervienen los orbitales y los electrones que en ello se encuentran.
Comentario
La unión de los átomos forma moléculas las cuales pueden ser moléculas de sustancias simples (cuando los átomos son iguales) o de sustancias compuestas (cuando los átomos son diferentes).
¿Qué es molécula?
·Es la mínima porción en que puede separarse la materia sin que pierda sus propiedades.
·Una molécula es una partícula formada por un conjunto de átomos ligados por enlaces covalentes, metálicos, o iónicos de forma que permanecen unidos el tiempo suficiente como para completar un número considerable de vibraciones moleculares.
Comentario
Es la unión de átomos y la mínima parte en que se puede dividir la materia.
¿Cómo se expresa la masa atómica y la masa molecular?
El mol es una unidad internacional básica que expresa la cantidad de masa atómica de un elemento simple o de masa molecular de masa compuesta contenida en una cierta cantidad de partículas.
Dicha cantidad fue determinada por el científico Avogadro en 6,023 x 1023.
Este número (llamado “Número Avogadro”) expresa la unidad de partículas elementales de cada elemento y de cada sustancia.
Comentario
La masa atómica y la masa molecular se expresan con la unidad básica “mol”. Esta cantidad fue de terminada por el científico Avogadro.
Una molécula esta formada por la unión de átomos (iguales o diferentes) y constituye la porción más pequeña en que podemos dividir una sustancia sin que pierda sus propiedades.
Comentario
La molécula está formada por átomos, por lo tanto son diferentes ya que el uno forma parte del otro.
¿Qué es radiactividad?
·Es la propiedad que poseen los núcleos de determinados átomos de desintegrarse espontáneamente, emitiendo partículas y radiaciones electromagnéticas.
Comentario
Radiactividad es la propiedad que poseen los núcleos de algunos átomos de desintegrarse voluntariamente emitiendo radiaciones electromagnéticas y partículas.
¿Qué es materia?
Todo lo que podemos ver y tocar es materia. También son materia cosas que no podemos ver, como el aire.Observamos que la materia ocupa una cierta porción de espacio que llamamos volumen. En el caso del aire esto no es evidente, pero la siguiente experiencia nos ayudará a comprobarlo.

¿Cuáles son los componentes de la materia?
La parte más pequeña en que se puede dividir la materia sin que pierda sus propiedades es la molécula. Esta, a su vez, puede dividirse en porciones más pequeñas, que se llaman átomos. Los átomos se unen formando moléculas. Al unirse las moléculas van constituyendo distintas sustancias.
Comentario
A la materia la componen las moléculas, las cuales se pueden dividir en partes más pequeñas llamadas átomos.
¿Qué es mezcla?
En una mezcla se unen dos o más sustancias sin perder sus propias características. Hay mezclas naturales y artificiales. Ejemplos sólidos son las rocas, como el basalto que es una mezcla de origen volcánico.
Comentario
En la mezcla se juntan dos o más sustancias sin perder sus características propias.
Las mezclas de un líquido, un sólido o un gas con un líquido se llaman soluciones. Al líquido se le llama disolvente, y al otro soluto.
¿Qué es alotropía?
Las moléculas pueden estar formadas por átomos iguales o distintos. Cuando se combinan átomos idénticos para obtener sustancias diferentes, decimos que se produce una alotropía.
Comentario
Una alotropía se produce cuando combinamos átomos idénticos para obtener sustancias distintas.
El protoplasma es la materia que constituye el cuerpo de los seres vivos .
Este está constituido por un 76% de sustancias inorgánicas y un 24 % de sustancias orgánicas.
Comentario
El protoplasma es la materia que constituye el cuerpo de los seres vivos.
¿Qué es una tabla periódica?
Todo comenzó a mediados del siglo XIX, varios químicos se dieron cuenta de que las similitudes en las propiedades químicas de diferentes elementos suponían una regularidad que podía ilustrarse ordenando los elementos de forma tabular o periódica. El químico ruso Dmitri Mendeléiev propuso una tabla de elementos llamada tabla periódica, en la que los elementos están ordenados en filas y columnas de forma que los elementos con propiedades químicas similares queden agrupados. Según este orden, a cada elemento se le asigna un número (número atómico) de acuerdo con su posición en la tabla, que va desde el 1 para el hidrógeno hasta el 92 para el uranio, que tiene el átomo más pesado de todos los elementos que existen de forma natural en nuestro planeta. Como en la época de Mendeléiev no se conocían todos los elementos, se dejaron espacios en blanco en la tabla periódica correspondientes a elementos que faltaban. Las posteriores investigaciones, facilitadas por el orden que los elementos conocidos ocupaban en la tabla, llevaron al descubrimiento de los elementos restantes. Los elementos con mayor número atómico tienen masas atómicas mayores, y la masa atómica de cada isótopo se aproxima a un número entero, de acuerdo con la hipótesis de Prout.

Comentario
La tabla periodica de los elementos es el orden de estos según su peso atómico en grupos o familias.
Tabla Periódica interactiva:
http://personal1.iddeo.es/romeroa/latabla/index.htm
¿ Qué son elementos biogenésicos?
Se denominan elementos biogenésicos a los elementos químicos que forman parte permanente de los seres vivos. Cuando se compara cualitativa y cuantitativamente los elementos que entran a formar parte de la materia viva y de la corteza terrestre, se encuentran bastantes diferencias que pueden explicarse, al menos parcialmente, teniendo en cuenta algunas consideraciones esencialmente químicas.
Comentario
Los elementos biogenésicos son aquellos que forman parte de los seres vivos y se encuentran en grandes cantidades en la corteza terrestre.

lunes, 12 de marzo de 2007 |
Publicado por
Julio Luis Coronel Oblitas
en
7:57
0
comentarios
![]()